Dr. Patricio Chrem Mendez - Prof. Dr. Ricardo F Allegri
Centro de Memoria y Envejecimiento Instituto de Investigaciones Neurológicas (FLENI)
De Augusta D a "Siempre Alice".... Una forma peculiar de enfermedad de Alzheimer de herencia familiar (DIAN-argentina)
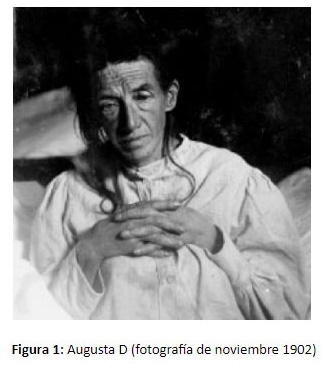
El 4 de noviembre de 1906, el neuropsiquiatra Alois Alzheimer en Tubingen (Alemania) en la Conferencia nº37 de los Psiquiatras del sud-oeste Alemán, describe por primera vez una paciente demente de 51 años llamada Augusta D. (ver figura 1) . La misma había comenzado con ideaciones celotípicas delirantes y pérdidas de memoria que luego fueron seguidas por un deterioro cognitivo progresivo. Falleció luego de 5 años de seguimiento y en la autopsia Alzheimer encontró un cuadro peculiar de la corteza cerebral con placas amiloideas, degeneración neurofibrilar y cambios arterioescleróticos. El psiquiatra alemán Emil Kraepelin (1910) de la escuela de Múnich y jefe de Alzheimer es el primero que le pone a esta enfermedad el nombre de Alzheimer en su tratado de Psiquiatría para adelantarse a publicaciones de casos similares de la escuela de Arnold Pick en Praga. Algunas característica llamaban la atención de este primer caso de la enfermedad de Alzheimer como la edad temprana, la sintomatología de comienzo y la rápida evolución inhabituales. Esto llevó recientemente a Muller y cols 2013) a estudiar genéticamente las muestras histopatológicas de Augusta D y encontrar que era una forma genética de herencia familiar con una mutación en PSEN 1 responsable de la enfermedad.
Julianne Moore gano el Oscar 2015 a la mejor actriz a partir de la película "Siempre Alice" (ver figura 2) donde personifica a una prestigiosa lingüista, profesora universitaria de 50 años quien comienza con un "lapsus en el que su memoria queda en blanco" en una conferencia. Al detectar estas pérdidas de memoria va al neurólogo quien le realiza pruebas entre ellas un PET (tomografía por emisión de positrones) cerebral con marcación de placas amiloideas (ver figura 3) a través del cual corrobora el diagnóstico de una enfermedad de Alzheimer. El diagnóstico es desolador padece un Alzheimer precoz. Su presente le está siendo robado a través de un pasado que va diluyéndose.
La película en ingles se llama "Still Alice" lamentablemente su traducción al castellano es errónea utilizado el siempre en lugar de todavía....el siempre es eterno el todavía implica que en un momento va a dejar de ser lo que es, como es el mensaje de la película.

Como sucedió con Augusta D. el comienzo temprano de esta enfermedad lleva a su neurólogo a explorar un origen genético encontrando el mismo en la paciente y posteriormente la carga genética en una de sus hijas.
Los pacientes con enfermedad de Alzheimer hereditaria con patrón autosómico dominante (EAAD) representan menos del 5% de todos los casos de enfermedad de Alzheimer (EA) y la mayoría tiene su comienzo en una etapa temprana de la vida (antes de los 60 años).
Las mutaciones que producen estas formas hereditarias de enfermedad de Alzheimer se producen en los genes de la presenilina 1 (PSEN1) - cromosoma 14, de la presenilina 2 (PSEN2) - cromosoma 1 y de la proteína precursora amiloide (APP) - cromosoma 21. Estas mutaciones se heredan en el 50% de la descendencia, tienen patrón de herencia dominante. Todos estos genes están relacionados al procesamiento de beta amiloide que forma la placa amiloidea. La herencia de un solo alelo mutado, tanto materno como paterno, es determinante de diagnóstico de EA (predicción cercana al 100%). Los portadores de mutaciones en los genes determinantes (PSEN1, PSEN2 y APP) ofrecen la oportunidad única de poner a prueba el valor predictivo de los biomarcadores en etapa preclínica, dado que además de la casi absoluta penetrancia, la edad de inicio resulta usualmente predecible (generalmente cercana a la edad de inicio del progenitor). Por otra parte los pacientes con EAAD comienzan a desarrollar los síntomas a edades tempranas, entre los 30 a 60 años, por lo cual generalmente están libres de otras co-morbilidades (enfermedad cerebrovascular).
Esta población es considerada de valor para el entendimiento de la fisiopatología de la enfermedad debido a que la EA comienza fisiopatológicamente más de 20 años antes de que se exprese clínicamente y en estas formas familiares la edad de comienzo es siempre la misma para esa familia. Con ello tendremos sujetos portadores sanos en los cuales sabemos exactamente cuando se expresara clínicamente la enfermedad y contaremos con un período asintomático pero con alteraciones fisiopatológicas. En los últimos años se han desarrollado métodos complementarios para estudiar en el sujeto vivo estas alteraciones como son los marcadores amiloideos y de proteína tau en cerebro.
El proyecto DIAN (de su sigla en inglés Dominantly Inherited Alzheimer Network) (ver figura 4) nace entre los centros de Alzheimer de EEUU bajo de dirección del Prof. John C. Morris (Universidad de Washington St Louis, EEUU) y es subsidiado por el Instituto Nacional de la Salud con el objetivo del estudio pre-clínico (pre-sintomático) de los familiares de pacientes con enfermedad de Alzheimer con patrón autosómico dominante (EAAD). Actualmente el mismo se ha extendido a Europa y Japón, y se encuentra en plan el Proyecto DIAN-TU “trials units” que prevé la intervención farmacológica en esta población.
El Centro de Memoria y Envejecimiento del Instituto de Investigaciones Neurológicas de la fundación FLENI se ha incorporado en nuestro medio a esta red de investigación para caracterizar los eventos clínicos y fisiopatológicos (cronopatología) en portadores de la enfermedad de Alzheimer familiar. Será evaluada y seguida una cohorte de sujetos (aproximadamente 20% serán portadores sintomáticos, 40% portadores asintomáticos y 40% no portadores asintomáticos) a los cuales se les realizará una evaluación clínica, neuropsicológica y neuropsiquiátrica. Se completara un laboratorio general, una genotipificación, estudio de biomarcadores (Aβ42, tau, tau-f, en LCR, RNM cerebro; PET-FDG y PET con PiB). Como parte del mismo proyecto el 5 y 6 de agosto del corriente año visitara Buenos Aires el Prof John Morris y dictara conferencias sobre los resultados preliminares del mismo.
Referencias
- Bateman RJ, Xiong C, Benzinger TL, et al. Dominantly Inherited Alzheimer Network. Clinical and biomarker changes in dominantly inherited Alzheimer's disease N Engl J Med. 2012;367(9):795-804.
- DIAN (Dominantly Inherited Alzheimer Network) http://www.dian-info.org/
- FLENI (Instituto de Investigaciones Neurológicas de la Fundación FLENI) http://www.fleni.org.ar
- Kraepelin E. Psychiatrie: Ein Lehrbuch fur Studierende und Arzte. Leipzig: Barth, 1910: 593-632.
- Maurer K, Volk S, Gerbaldo H. Auguste D and Alzheimer's disease. The Lancet 1997; 349: 1546-1549.
- Muller U, Winter P, Graeber MB. A presenilin 1 mutation in the first case of Alzheimer's disease. The Lancet 2013; 129-130.
- Riudavets MA, Bartoloni L, Troncoso JC, Pletnikova O, St George-Hyslop P, Schultz M, Sevlever G, Allegri RF. Familial dementia with frontotemporal features associated with Met146Val presenilin-1 mutation. Brain Pathology 2013; 23 (5): 595-600.
Publicado en “Revista de ALMA” vol VI año 2015




